近日,我校特聘教授刘兴国老师团队在Nature Communications(IF=15.7,Nature子刊)上发表了题为《Microprotein PLUM encoded by Lin28b uORF is a cytoplasmic determinant of pluripotency and embryonic development》的研究论文,揭示了多能干细胞中首个由非经典阅读框编码的功能蛋白PLUM,在亚细胞水平连接无膜细胞器的RNA调控与线粒体代谢的翻译重塑,在多能性与胚胎发育中发挥关键的决定性作用。中国科学院广州生物医药与健康研究所、中国科学院香港科技创新研究院再生医学与健康研究中心、天府金城实验室前沿医学中心、皖南医学院等为本研究的共同作者单位,我校特聘教授刘兴国为本研究的唯一通讯作者,基础医学院青年博士王琪作为文章署名作者参与该项研究工作。

文章封面
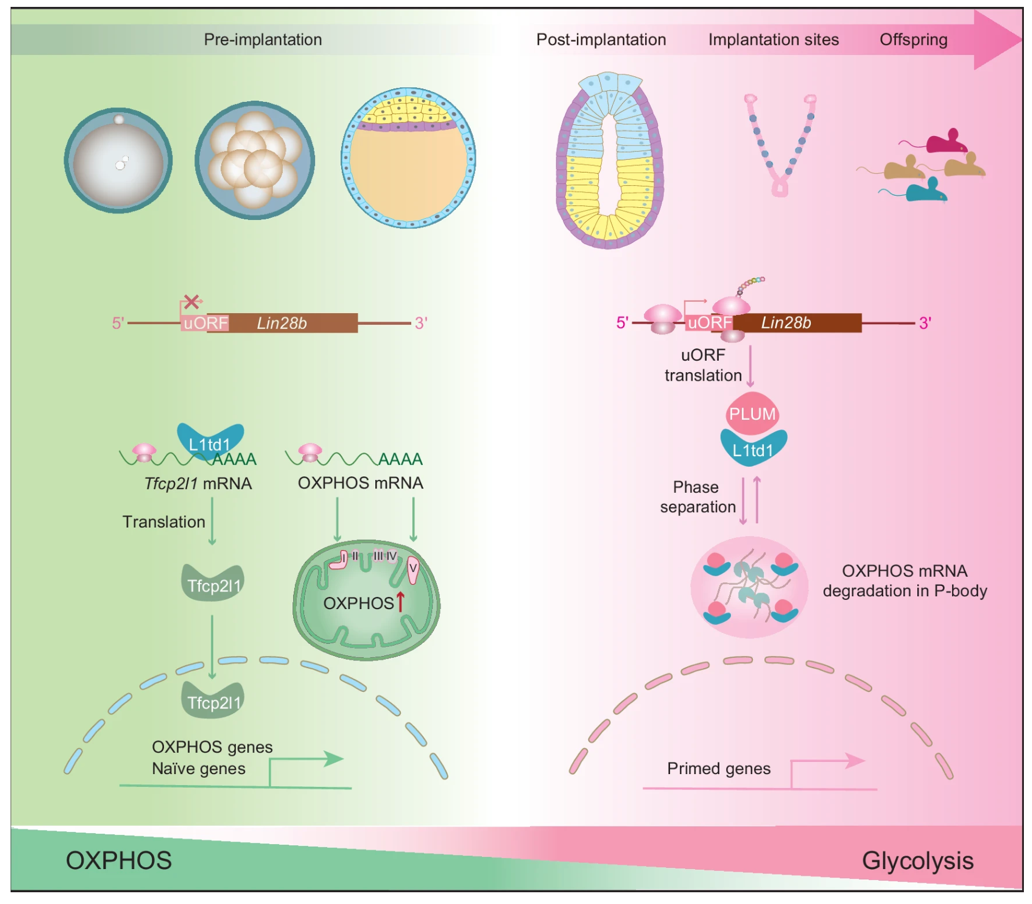
胚胎发育是一个复杂而精确调控的过程,而翻译控制在细胞命运决定和早期胚胎发育中起着关键作用。团队首先利用核糖体测序系统分析了体细胞与不同多能性状态干细胞中的翻译变化,并发现多能代谢因子Lin28b 5’UTR区uORF在Primed多能性状态中发生特异翻译,可能编码一个哺乳动物高度保守的全新蛋白,命名为PLUM。随后,研究者构建了PLUM敲除的多能干细胞系及小鼠模型,发现PLUM敲除可促使小鼠Primed状态多能干细胞以接近100%的效率同步转变为Naïve状态,并导致体内胚胎着床缺陷,表明PLUM具有决定性的强大功能。
研究示意图
机制探索中,团队进行了时间序列的转录组分析,发现PLUM敲除改变了Naïve多能性基因表达的模式,加速了Naïve基因更均一的表达。值得注意的是,PLUM敲除使线粒体呼吸链复合物相关基因表达在转变早期骤然升高,表明线粒体代谢在其中起关键作用。进一步研究发现PLUM与RNA结合蛋白L1td1直接互作。L1td1在胞质中通过相分离形成点状凝聚体,而PLUM敲除会破坏这一结构,使L1td1聚集完全消失,并彻底改变其在多能性 Primed-Naïve 转换中的功能。接下来,团队利用eCLIP-seq分析发现PLUM敲除改变了L1td1结合的下游靶标,使L1td1特异结合Naïve多能性基因Tfcp2l1和Zfp42的mRNA,从而提高了它们的RNA稳定性。而Tfcp2l1可直接结合并激活Naïve和线粒体呼吸链复合物基因的表达。另一方面,PLUM敲除也破坏了细胞中负责 mRNA 降解的P颗粒,提示PLUM可能通过P颗粒组装调控线粒体呼吸功能。结合基因敲除小鼠及胚胎移植实验,研究团队发现PLUM的缺失会引发线粒体异常活化,最终导致胚胎着床率显著下降。
综上,刘兴国教授团队揭示了PLUM这一新蛋白,它的缺失会导致小鼠胚胎着床失败,说明它在生命最初阶段扮演着不可或缺的角色。机制研究将“RNA调控—相分离—线粒体代谢”三者串联,揭示细胞质事件如何反向决定细胞核的多能性状态。该研究不仅为理解多能干细胞命运决定提供全新视角,也为优化多能干细胞状态、改善辅助生殖胚胎质量提供了全新的理论基础与潜在干预靶点。(王琪/文、图)
原文链接:https://www.nature.com/articles/s41467-025-66297-4
 联系地址:中国安徽省芜湖市弋江区文昌西路22号
联系地址:中国安徽省芜湖市弋江区文昌西路22号 联系方式:0553-3932459 邮编:241002
联系方式:0553-3932459 邮编:241002 举报电话:0553-3932753 邮箱:jcjw@wnmc.com.cn
举报电话:0553-3932753 邮箱:jcjw@wnmc.com.cn